Ισχυρισμός 1:
Τα χορηγούμενα εμβόλια κατά του κορωνοϊού SARS-CoV-2 είναι πειραματικά και όσοι τα λαμβάνουν είναι πειραματόζωα.
Συμπέρασμα 1:
Τα εμβόλια που κυκλοφορούν αυτή τη στιγμή για τον ιό SARS-CoV-2 έχουν περάσει τις απαραίτητες φάσεις κλινικών δοκιμών. Τα σκευάσματα χρησιμοποιούνται στον γενικό πληθυσμό κατόπιν αξιολόγησης από διακρατικούς, διεθνείς και εθνικούς φορείς υγείας, με διαδικασία υπό όρους άδειας ή άδειας έκτακτης χρήσης, με σκοπό την αντιμετώπιση της πανδημίας COVID-19.
Ισχυρισμός 2:
Ο Παγκόσμιος Οργανισμός Υγείας λέει ότι τα εμβόλια που χρησιμοποιούνται είναι πειραματικά. Τα περιγράφει ως conditional, δηλαδή ότι βρίσκονται ακόμη σε πειραματικό στάδιο.
Συμπέρασμα 2:
Ο Παγκόσμιος Οργανισμός Υγείας δεν αναφέρεται στα χρησιμοποιούμενα εμβόλια ως «πειραματικά». Έχει καταχωρίσει για επείγουσα χρήση (Emergency Use Listing Procedure) σκευάσματα των Pfizer/BioNTech, Astrazeneca-SK Bio, Serum Institute of India, Janssen, Moderna και Sinopharm. Ο όρος «conditional» δεν ταυτίζεται με την έννοια του «πειραματικού» ή του «ευρισκόμενου σε πειραματικό στάδιο», αλλά σημαίνει «υπό όρους». Αποτελεί ορολογία που χρησιμοποιεί η Ευρωπαϊκή Ένωση και όχι ο Παγκόσμιος Οργανισμός Υγείας, στο πλαίσιο της διαδικασίας χορήγησης «άδειας κυκλοφορίας υπό όρους (conditional marketing authorisation)».

Εκατοντάδες χιλιάδες προβολές και αρκετές εκατοντάδες κοινοποιήσεις είχε συνολικά το Μάιο του 2021 απόσπασμα από τηλεοπτική εκπομπή στην οποία εμφανίστηκε ο Κυριάκος Βελόπουλος, και στην οποία διατύπωσε τον ισχυρισμό ότι όσοι εμβολιάζονται για τον κορωνοϊό είναι πειραματόζωα. Στην ίδια εκπομπή ανέφερε επίσης πως ο Παγκόσμιος Οργανισμός Υγείας και οι εταιρίες παραγωγής των εμβολίων κατά της COVID-19 παραδέχονται ότι τα εμβόλια βρίσκονται ακόμη σε πειραματικό στάδιο. Ωστόσο, οι εν λόγω ισχυρισμοί δεν ανταποκρίνονται στην πραγματικότητα.
Παραδείγματα: Έλληνες ξυπνήστε (σελίδα Facebook), Rantar (κανάλι YouTube),
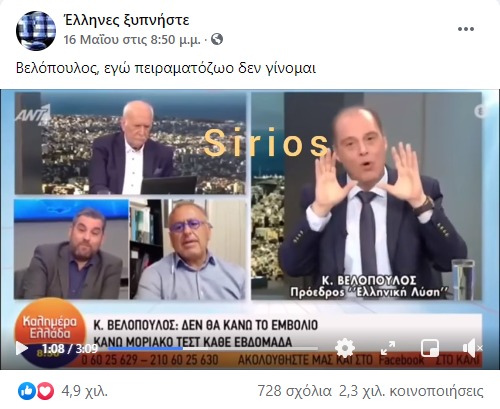
Το βίντεο στην ανάρτηση αυτή έχει τουλάχιστον 160 χιλιάδες προβολές.
Το απόσπασμα που αναπαρήχθη ευρέως είναι το τελευταίο τμήμα της εμφάνισης του Κ. Βελόπουλου στον τηλεοπτικό σταθμό ANT1, στην εκπομπή «Καλημέρα Ελλάδα» της 13/05/2021 (δείτε παρακάτω μετά το 19:28):
Συγκεκριμένα, αναφέρθηκαν τα εξής:
Παπαδάκης: Θα πάτε [να κάνετε το εμβόλιο];
Βελόπουλος: Όχι, το ‘χω πει. Πλάκα κάνεις; Εγώ δεν κάνω βήμα πίσω, κύριε Παπαδάκη. Το ‘χω πει, ο καθένας έχει το δικαίωμα να κάνει ό,τι θέλει. Εγώ πειραματόζωο δεν γίνομαι! (…)
Φώσκολου: Είναι πειραματόζωα, κ. Βελόπουλε, οι πολίτες;
Παπαδάκης: Είμαι πειραματόζωο;
Βελόπουλος: Ναι! Δυστυχώς, το λένε οι εταιρίες και ο ΠΟΥ! Λένε ότι είναι conditional το εμβόλιο, δηλαδή ότι είναι πειραματικό το στάδιό του, δεν είναι αναγνωρισμένο, δεν είναι επίσημο! Ψάξτε το!
Τι ισχύει
Με ψευδείς δηλώσεις ή αναπαραγωγή ψευδών ειδήσεων από τον κ. Κυριάκο Βελόπουλο σχετικά με την πανδημία της COVID-19 και τα εμβόλια για την νόσο έχουμε ασχοληθεί σε προηγούμενα άρθρα μας τα οποία μπορείτε να βρείτε εδώ, εδώ, εδώ, εδώ και εδώ.
Για τις κλινικές μελέτες των εμβολίων για την COVID-19, τα οποία είναι διαθέσιμα αυτή τη στιγμή στην Ευρωπαϊκή Ένωση και στις οποίες συμμετείχαν δεκάδες χιλιάδες άνθρωποι, έχουν δημοσιευθεί τα αναλυτικά αποτελέσματα τους σε έγκριτα επιστημονικά περιοδικά τα οποία ήταν απαραίτητα προκειμένου να δοθεί η έγκριση κυκλοφορίας από τους αρμόδιους φορείς υγείας. [πηγή 1][πηγή 2][πηγή 3][πηγή 4][πηγή 5][πηγή 6]
Ο όρος «conditional» που χρησιμοποιεί ο κ. Βελλόπουλος αφορά τη διαδικασία χορήγησης «άδειας κυκλοφορίας υπό όρους – conditional marketing authorisation» – ορολογία που χρησιμοποιεί η Ευρωπαϊκή Ένωση και όχι ο Παγκόσμιος Οργανισμός Υγείας (ΠΟΥ).
Η διαδικασία αδειοδότησης των εμβολίων κατά της COVID-19 στην ΕΕ
Στην Ελλάδα, κατόπιν έγκρισης για χορήγηση άδειας χρήσης υπό όρους (conditional marketing authorisation), από την αρμόδια Επιτροπή Φαρμάκων για Ανθρώπινη Χρήση του Ευρωπαϊκού Οργανισμού Φαρμάκων (EMA), είναι διαθέσιμα τα σκευάσματα των BioNTech/Pfizer, Moderna, AstraZeneca, Janssen (Johnson&Johnson).
Πηγή: Επίσημη Εφημερίδα της Ευρωπαϊκής Ένωσης (C 447 I/1, 24-12-20).
Στον ιστότοπο της Ευρωπαϊκής Επιτροπής ec.europa.eu διαβάζουμε τα εξής:
Ανεξάρτητη επιστημονική αξιολόγηση της ασφάλειας, της αποτελεσματικότητας και της ποιότητας από τον Ευρωπαϊκό Οργανισμό Φαρμάκων
Κάθε φορέας ανάπτυξης εμβολίων που επιθυμεί να διαθέσει εμβόλιο στην αγορά της ΕΕ θα πρέπει πρώτα να ζητήσει άδεια κυκλοφορίας για το εμβόλιο. Το αίτημα υποβάλλεται στον Ευρωπαϊκό Οργανισμό Φαρμάκων (EMA), ο οποίος αξιολογεί την ασφάλεια, την αποτελεσματικότητα και την ποιότητα του εμβολίου. Εάν ο ΕΜΑ εκδώσει θετική σύσταση, η Επιτροπή μπορεί να προχωρήσει στην αδειοδότηση του εμβολίου για κυκλοφορία στην αγορά της ΕΕ.
Για την αντιμετώπιση απειλών κατά της δημόσιας υγείας, όπως η παρούσα πανδημία, η ΕΕ διαθέτει ένα ειδικό ρυθμιστικό εργαλείο που επιτρέπει την έγκαιρη διάθεση φαρμάκων για χρήση σε καταστάσεις έκτακτης ανάγκης. Η διαδικασία χορήγησης άδειας κυκλοφορίας υπό όρους έχει σχεδιαστεί ειδικά για να επιτρέπει τη χορήγηση αδειών κυκλοφορίας το συντομότερο δυνατόν, μόλις συγκεντρωθούν επαρκή στοιχεία, ακριβώς σε τέτοιες καταστάσεις έκτακτης ανάγκης. Η διαδικασία αυτή παρέχει στην ΕΕ ένα άρτιο πλαίσιο για ταχύτερη έγκριση και για μετεγκριτικές διασφαλίσεις και ελέγχους της ασφάλειας.
Κατά την αξιολόγησή του, ο ΕΜΑ θα διεξαγάγει ανεξάρτητη, διεξοδική και εμπεριστατωμένη αξιολόγηση όλων των στοιχείων που έχει υποβάλει ο φορέας ανάπτυξης του εμβολίου. Η διαδικασία περιλαμβάνει διάφορους μηχανισμούς ελέγχου και εξισορρόπησης και βασίζεται σε ένα σύστημα αξιολογήσεων από ομοτίμους με τη συμμετοχή πολλών εμπειρογνωμόνων: δύο εισηγητές αρμόδιους για την αξιολόγηση, έναν ομότιμο αξιολογητή, ειδικές επιτροπές και ομάδες εργασίας (π.χ. η Επιτροπή Φαρμακοεπαγρύπνησης – Αξιολόγησης Κινδύνου (PRAC) ως προς την ασφάλεια, η Ομάδα Εργασίας για τα Βιολογικά Φάρμακα ως προς την ποιότητα κ.λπ.) και, τέλος, την επιτροπή του EMA για τα φάρμακα για ανθρώπινη χρήση (όπου συμμετέχουν ειδικοί από όλα τα κράτη μέλη), η οποία εκδίδει τη σύσταση.
Η Επιτροπή Φαρμάκων για Ανθρώπινη Χρήση εκδίδει θετική σύσταση μόνον όταν τα στοιχεία αποδεικνύουν πειστικά ότι τα οφέλη του εμβολιασμού είναι μεγαλύτερα από τυχόν κινδύνους από το εμβόλιο.
Τι αναφέρει ο Παγκόσμιος Οργανισμός Υγείας
Παραπάνω σημειώσαμε ότι, όσον αφορά τη χρήση των εμβολίων κατά της COVID-19, ο Παγκόσμιος Οργανισμός Υγείας δεν χρησιμοποιεί τον όρο «conditional», τον οποίο παραθέτει ο κ. Βελόπουλος, ψευδώς, ως όρο ταυτόσημο της έννοιας του «πειραματικού σταδίου» μελετών, στο οποίο υποτίθεται ότι βρίσκονται.
Επιπλέον, δεν κατέστη δυνατόν να εντοπίσουμε στην επίσημη ιστοσελίδα του ΠΟΥ αναφορά στα εγκεκριμένα εμβόλια κατά της COVID-19 ως πειραματικά, δηλαδή “experimental“.
Για την ακρίβεια, τον όρο «πειραματικό εμβόλιο» χρησιμοποιεί ο Παγκόσμιος Οργανισμός Υγείας κατά κανόνα όταν αναφέρεται σε υπό ανάπτυξη, υποψήφιο εμβόλιο κατά το στάδιο των προκλινικών ή κλινικών μελετών. [πηγή 1][πηγή 2][πηγή 3][πηγή 4]
Για παράδειγμα, σε σελίδα στην οποία εξηγείται η διαδικασία ανάπτυξης ενός εμβολίου αναγράφονται τα εξής:
Πώς αναπτύσσονται τα εμβόλια;
Τα περισσότερα εμβόλια χρησιμοποιούνται εδώ και δεκαετίες, με εκατομμύρια ανθρώπους να τα λαμβάνουν με ασφάλεια κάθε χρόνο. Όπως συμβαίνει με όλα τα φάρμακα, κάθε εμβόλιο πρέπει να υποβληθεί σε εκτεταμένες και αυστηρές δοκιμές για να διασφαλίσει ότι είναι ασφαλές προτού μπορέσει να εισαχθεί στο πρόγραμμα εμβολίων μιας χώρας.
Κάθε εμβόλιο που βρίσκεται υπό ανάπτυξη πρέπει πρώτα να υποβληθεί σε διαλογές και αξιολογήσεις για να προσδιορίσει ποιο αντιγόνο πρέπει να χρησιμοποιηθεί για να προκαλέσει ανοσοαπόκριση. Αυτή η προκλινική φάση γίνεται χωρίς δοκιμές σε ανθρώπους. Ένα πειραματικό εμβόλιο δοκιμάζεται πρώτα σε ζώα για να αξιολογηθεί η ασφάλειά του και η πιθανότητα πρόληψης ασθένειας.
Εάν το εμβόλιο προκαλεί ανοσοαπόκριση, τότε δοκιμάζεται σε κλινικές δοκιμές σε ανθρώπους σε τρεις φάσεις.
Όσον αφορά τα εμβόλια κατά της COVID-19, ο Παγκόσμιος Οργανισμός Υγείας έχει ακολουθήσει τη διαδικασία Emergency Use Listing Procedure (EUL), δηλαδή Καταχώριση Για Επείγουσα Χρήση. Συγκεκριμένα, πρόκειται για μία διαδικασία, η οποία έχει ως στόχο την εκτίμηση κινδύνου (risk-based), για την αξιολόγηση της καταλληλόλητας νέων προϊόντων υγείας κατά τη διάρκεια έκτακτης ανάγκης στη δημόσια υγεία. Κατά τον Παγκόσμιο Οργανισμό Υγείας:
Ο στόχος είναι η διάθεση φαρμάκων, εμβολίων και διαγνωστικών όσο το δυνατόν γρηγορότερα για την αντιμετώπιση της έκτακτης ανάγκης, τηρώντας παράλληλα αυστηρά κριτήρια ασφάλειας, αποτελεσματικότητας και ποιότητας. Η αξιολόγηση σταθμίζει την απειλή που δημιουργεί η κατάσταση έκτακτης ανάγκης καθώς και το όφελος που θα προκύψει από τη χρήση του προϊόντος έναντι τυχόν δυνητικών κινδύνων.
Για τα εμβόλια κατά της COVID-19 είχε τεθεί η προϋπόθεση να έχουν υποβληθεί σε μελέτες τουλάχιστον φάσης ΙΙβ ή φάσης ΙΙΙ, και να έχουν υποβληθεί για αξιολόγηση και παρακολούθηση από την εκάστοτε εθνική ρυθμιστική αρχή. [πηγή 1][πηγή 2][πηγή 3]
Ο Παγκόσμιος Οργανισμός Υγείας έχει καταχωρίσει για επείγουσα χρήση τα εμβόλια των εταιριών Pfizer/BioNTech, Astrazeneca, Serum Institute of India, Janssen, Moderna και Sinopharm. Σε κανένα από αυτά δεν αναφέρεται ως πειραματικά.
Μάλιστα σε πρόσφατη επιστολή του ο Ευρωπαϊκός Οργανισμός Φαρμάκων λέει ξεκάθαρα πως όταν ένα προϊόν λάβει άδεια χρήσης υπό όρους (conditional marketing authorization) δεν θεωρείται πλέον πειραματικό. [πηγή]
Τέλος, δεν εντοπίσαμε ανακοινώσεις εταιριών στις οποίες να ενημερώνουν ή να «παραδέχονται» ότι τα εμβόλια έναντι του κορωνοϊού, παρ’ όλο που έλαβαν επείγουσα αδειοδότηση, βρίσκονται σε πειραματικό στάδιο.
Συμπέρασμα
Για τα εγκεκριμένα για επείγουσα χρήση ή αδειοδοτηθέντα υπό όρους εμβόλια κατά του κορωνοϊού SARS-CoV-2 έχουν διεξαχθεί οι απαραίτητες προκλινικές και κλινικές μελέτες, και δεν βρίσκονται σε «πειραματικό» στάδιο. Επίσης δεν αληθεύει ότι ο Παγκόσμιος Οργανισμός Υγείας αναφέρεται στα εμβόλια που έχουν λάβει την σχετική αδειοδότηση ως «πειραματικά». Ο όρος «conditional» που χρησιμοποιείται από ορισμένους επίσημους φορείς υγείας δεν ταυτίζεται με την έννοια του «πειραματικού» ή του «ευρισκόμενου σε πειραματικό στάδιο», αλλά σημαίνει «υπό όρους» και αποτελεί ορολογία που χρησιμοποιεί η Ευρωπαϊκή Ένωση και όχι ο Παγκόσμιος Οργανισμός Υγείας, στο πλαίσιο της διαδικασίας χορήγησης «άδειας κυκλοφορίας υπό όρους (conditional marketing authorisation)».

 Ευαίσθητο περιεχόμενο
Ευαίσθητο περιεχόμενο



 Ευαίσθητο περιεχόμενο
Ευαίσθητο περιεχόμενο
 Ευαίσθητο περιεχόμενο
Ευαίσθητο περιεχόμενο
 Ευαίσθητο περιεχόμενο
Ευαίσθητο περιεχόμενο
 Ευαίσθητο περιεχόμενο
Ευαίσθητο περιεχόμενο




